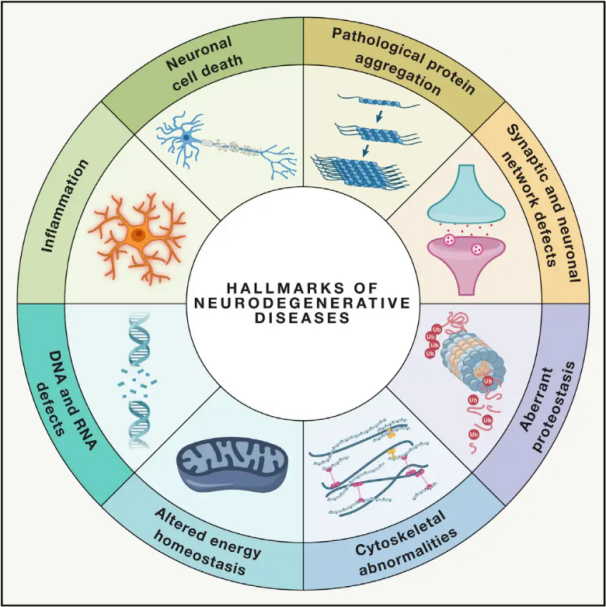
Нейрадэгенератыўныя захворванні(НДД) характарызуюцца прагрэсавальнай або ўстойлівай стратай пэўных уразлівых нейрональных папуляцый у галаўным або спінным мозгу. Класіфікацыя НДД можа грунтавацца на розных крытэрыях, у тым ліку на анатамічным размеркаванні нейрадэгенерацыі (напрыклад, экстрапірамідных засмучэннях, лобна-скроневай дэгенерацыі або спінамазачкавай атаксіі), першасных малекулярных анамаліях (напрыклад, β-амілоідзе, прыёнах, тау-бялок або α-сінуклеіне) або асноўных клінічных прыкметах (напрыклад, хваробе Паркінсана, бакавым аміятрафічным склерозе і дэменцыі). Нягледзячы на гэтыя адрозненні ў класіфікацыі і праяўленні сімптомаў, такія захворванні, як хвароба Паркінсана (ХП), бакавы аміятрафічны склероз (БАС) і хвароба Альцгеймера (ХА), маюць агульныя асноўныя працэсы, якія прыводзяць да нейрональнай дысфункцыі і ў канчатковым выніку да гібелі клетак.
Паводле ацэнак Сусветнай арганізацыі аховы здароўя, да 2040 года мільёны людзей па ўсім свеце пакутуюць ад неўрадэгенератыўных захворванняў (НЗЗ). Нягледзячы на тое, што існуюць розныя метады лячэння і лячэння сімптомаў, звязаных з пэўнымі захворваннямі, эфектыўныя метады запаволення або лячэння гэтых станаў застаюцца нявысветленымі. Нядаўнія даследаванні сведчаць аб зруху ў парадыгмах лячэння ад простага сімптаматычнага лячэння да выкарыстання механізмаў абароны клетак для прадухілення далейшага пагаршэння. Шматлікія дадзеныя сведчаць аб тым, што акісляльны стрэс і запаленне адыгрываюць ключавую ролю ў нейрадэгенерацыі, што пазіцыянуе гэтыя механізмы як крытычныя мішэні для клетачнай абароны. У апошнія гады фундаментальныя і клінічныя даследаванні раскрылі патэнцыял гіпербарычнай кіслароднай тэрапіі (ГБА) у лячэнні нейрадэгенератыўных захворванняў.
Разуменне гіпербарычнай кіслароднай тэрапіі (ГБАТ)
ГБАТ звычайна прадугледжвае павышэнне ціску вышэй за 1 абсалютную атмасферу (АТ) — ціск на ўзроўні мора — на працягу 90-120 хвілін, часта патрабуючы некалькіх сеансаў у залежнасці ад канкрэтнага захворвання, якое лячыцца. Павышаны ціск паветра паляпшае дастаўку кіслароду да клетак, што, у сваю чаргу, стымулюе праліферацыю ствалавых клетак і ўзмацняе працэсы гаення, апасродкаваныя пэўнымі фактарамі росту.
Першапачаткова прымяненне ГБАТ было заснавана на законе Бойля-Марыёта, які пастулюе залежнае ад ціску памяншэнне колькасці газавых бурбалак, а таксама перавагі высокага ўзроўню кіслароду ў тканінах. Вядома, што існуе шэраг паталогій, якія паляпшаюць стан гіпераксіі, выкліканы ГБАТ, у тым ліку некратычныя тканіны, прамянёвыя пашкоджанні, траўмы, апёкі, сіндром аддзялення і газавая гангрэна, сярод іншых, пералічаных Падводным і гіпербарычным медыцынскім таварыствам. Варта адзначыць, што ГБАТ таксама паказала эфектыўнасць у якасці дадатковага лячэння пры розных запаленчых або інфекцыйных захворваннях, такіх як каліт і сепсіс. Улічваючы свае супрацьзапаленчыя і акісляльныя механізмы, ГБАТ мае значны патэнцыял у якасці тэрапеўтычнага шляху для нейрадэгенератыўных захворванняў.
Даклінічныя даследаванні гіпербарычнай кіслароднай тэрапіі пры нейрадэгенератыўных захворваннях: вынікі мадэлі мышэй 3×Tg
Адно з прыкметных даследаванняўДаследаванне было сканцэнтравана на мадэлі хваробы Альцгеймера (ХА) на мышах з 3×Tg, якая прадэманстравала тэрапеўтычны патэнцыял ГБАТ у паляпшэнні кагнітыўных парушэнняў. У даследаванні ўдзельнічалі 17-месячныя самцы мышэй 3×Tg у параўнанні з 14-месячнымі самцамі мышэй C57BL/6, якія служылі кантрольнай групай. Даследаванне паказала, што ГБАТ не толькі паляпшае кагнітыўныя функцыі, але і значна зніжае запаленне, нагрузку бляшкамі і фасфараляванне тау-бялок — крытычны працэс, звязаны з паталогіяй ХА.
Ахоўныя эфекты ГБАТ былі звязаны са зніжэннем нейрапапалажэння. Гэта пацвердзілася зніжэннем праліферацыі мікрагліі, астрагліёзу і сакрэцыі прозапаленчых цытакінаў. Гэтыя вынікі падкрэсліваюць двайную ролю ГБАТ у паляпшэнні кагнітыўных здольнасцей і адначасовым змякчэнні нейрапапалавых працэсаў, звязаных з хваробай Альцгеймера.
У іншай даклінічнай мадэлі выкарыстоўваліся мышы з 1-метыл-4-феніл-1,2,3,6-тэтрагідрапірыдынам (MPTP) для ацэнкі ахоўных механізмаў ГБАТ у дачыненні да нейрональнай функцыі і рухальных здольнасцей. Вынікі паказалі, што ГБАТ спрыяла павышэнню рухальнай актыўнасці і сілы счаплення ў гэтых мышэй, што карэлюе з павелічэннем сігналізацыі мітахондрыяльнага біягенезу, у прыватнасці, праз актывацыю SIRT-1, PGC-1α і TFAM. Гэта падкрэслівае значную ролю мітахондрыяльнай функцыі ў нейрапратэктарным эфекты ГБАТ.
Механізмы ГБАТ пры нейрадэгенератыўных захворваннях
Асноўны прынцып выкарыстання ГБАТ пры неўралагічных дэгенератыўных захворваннях (НДЗ) заключаецца ў сувязі паміж зніжэннем паступлення кіслароду і схільнасцю да нейрадэгенератыўных змен. Гіпаксія-індуцыбельны фактар-1 (HIF-1) адыгрывае цэнтральную ролю ў якасці транскрыпцыйнага фактару, які забяспечвае клетачную адаптацыю да нізкага ціску кіслароду, і быў звязаны з рознымі НДЗ, у тым ліку з хваробай Альцгеймера, хваробай Паркінсана, хваробай Хантынгтана і бакавымі аміятрофільнымі аміятрофіламі (БАС), што робіць яго ключавой мішэнню для лекаў.
Паколькі ўзрост з'яўляецца значным фактарам рызыкі развіцця шматлікіх нейрадэгенератыўных захворванняў, вывучэнне ўплыву ГБАТ на нейрабіялогію старэння мае жыццёва важнае значэнне. Даследаванні паказалі, што ГБАТ можа палепшыць узроставыя кагнітыўныя парушэнні ў здаровых пажылых людзей.Акрамя таго, у пажылых пацыентаў са значнымі парушэннямі памяці назіраліся паляпшэнні кагнітыўных функцый і павелічэнне мазгавога кровазвароту пасля ўздзеяння ГБАТ.
1. Уплыў ГБАТ на запаленне і акісляльны стрэс
ГБАТ прадэманстравала здольнасць палягчаць нейразапаленне ў пацыентаў з цяжкай дысфункцыяй мозгу. Яна валодае здольнасцю зніжаць узровень прозапаленчых цытакінаў (такіх як IL-1β, IL-12, TNFα і IFNγ), адначасова павялічваючы ўзровень супрацьзапаленчых цытакінаў (такіх як IL-10). Некаторыя даследчыкі мяркуюць, што актыўныя формы кіслароду (АФК), якія ўтвараюцца пры ГБАТ, апасродкуюць некалькі карысных эфектаў тэрапіі. Такім чынам, акрамя яго дзеяння па зніжэнні ўзроўню бурбалак у залежнасці ад ціску і дасягнення высокай насычанасці тканін кіслародам, станоўчыя вынікі, звязаныя з ГБАТ, часткова залежаць ад фізіялагічных роляў выпрацоўваемых АФК.
2. Уплыў ГБАТ на апоптоз і нейрапратэкцыю
Даследаванні паказалі, што ГБАТ можа зніжаць фасфараляванне мітоген-актываванай пратэінкіназы (MAPK) p38 у гіпакампе, што, у сваю чаргу, паляпшае кагнітыўныя функцыі і памяншае пашкоджанне гіпакампа. Было выяўлена, што як асобная ГБАТ, так і ў спалучэнні з экстрактам гінкга білоба зніжаюць экспрэсію Bax і актыўнасць каспазы-9/3, што прыводзіць да зніжэння частаты апоптозу ў мадэлях грызуноў, выкліканага αβ25-35. Акрамя таго, іншае даследаванне паказала, што папярэдне набыццё ГБАТ выклікала талерантнасць да цэрэбральнай ішэміі з механізмамі, якія ўключаюць павышэнне экспрэсіі SIRT1, разам з павелічэннем узроўню В-клетачнай лімфомы 2 (Bcl-2) і зніжэннем актыўнасці каспазы-3, што падкрэслівае нейрапратэктарныя і антыапаптатычныя ўласцівасці ГБАТ.
3. Уплыў ГБАТ на кровазварот іНейрагенез
Уздзеянне ГБАТ асацыюецца з шматлікімі наступствамі для чэрапна-мазгавой сасудзістай сістэмы, у тым ліку з павышэннем пранікальнасці гематаэнцэфалічна-га бар'ера, стымуляцыяй ангіягенезу і памяншэннем ацёкаў. Акрамя забеспячэння павелічэння паступлення кіслароду ў тканіны, ГБАТспрыяе фарміраванню сасудаўшляхам актывацыі транскрыпцыйных фактараў, такіх як фактар росту эндатэлія сасудаў, і стымуляцыі праліферацыі нервовых ствалавых клетак.
4. Эпігенетычныя эфекты ГБАТ
Даследаванні паказалі, што ўздзеянне гіпербарычнага кіслароду на клеткі мікрасасудзістага эндатэлія чалавека (HMEC-1) значна рэгулюе 8101 ген, у тым ліку як павышаную, так і паніжаную экспрэсію, што сведчыць пра павелічэнне экспрэсіі генаў, звязанае са шляхамі антыаксідантнага адказу.
Выснова
Выкарыстанне ГБАТ з цягам часу значна пашырылася, што даказвае яго даступнасць, надзейнасць і бяспеку ў клінічнай практыцы. Нягледзячы на тое, што ГБАТ вывучалася як нерэгістрацыйны метад лячэння неўралагічных дэпрэсій (НДЗ) і былі праведзены некаторыя даследаванні, застаецца вострая патрэба ў дбайных даследаваннях для стандартызацыі практыкі ГБАТ пры лячэнні гэтых захворванняў. Для вызначэння аптымальнай частаты лячэння і ацэнкі ступені карыснага эфекту для пацыентаў неабходныя далейшыя даследаванні.
Карацей кажучы, спалучэнне гіпербарычнай аксідацыі і нейрадэгенератыўных захворванняў дэманструе перспектыўныя межы тэрапеўтычных магчымасцей, што патрабуе далейшых даследаванняў і праверкі ў клінічных умовах.
Час публікацыі: 16 мая 2025 г.

